Einleitung–was hat Omega-3 mit gynäkologischer Endokrinologie zu tun?
Die wichtigsten Omega-3-Fettsäuren (im Folgenden nur mit Omega-3 abgekürzt) sind ALA (Alpha-Linolensäure, z.B. aus Leinöl), EPA und DHA (Eicosapentaen und Docosahexaensäure, z.B.aus Fisch oder Algenöl, .Abb.1). Während ALA fast ausschließlich als hochkalorischer Brennstoff dient, sind EPA und DHA Präkursoren vieler Hormone, z.B. von antiinflammatorischen Prostaglandinen, Leukotrienen und Resolvinen, Maresinen, Protectinen und Endocannabinoiden [3]. Entgegen immer wieder im Internet und in anderen Publikationen gelesenen Äußerungen wird ALA kaum in EPA und gar nicht in DHA umgewandelt, selbst wenn sehr hohe Mengen eingesetzt werden (z.B. 8EL täglich, [18]). Die oben erwähnten Hormone, besonders die Prostaglandine, sind vermutlich für die vielen protektiven Effekte in der Schwangerschaft für Mutter und Kind verantwortlich, z.B. für weniger Frühgeburten und perinatale Todesfälle, ein geringeres Risiko eines niedrigen Geburtsgewichts, weniger Schwangerschaftsdepression, weniger Präeklampsie und ein geringeres Risiko für atopische Erkrankungen bei den Kindern.
Übersicht
1. Review–wobei hilft Omega-3?
2. Können wir „Frühchen“ verhindern?
3. Vermeidung atopischer Erkrankungen
4. Perinataler Tod
5. Stimmungsaufhellungdurch Omega-3?
6. Hashimoto – die häufigste Autoimmunkrankheit
7. Diabetes – die „süße“ Schwangerschaftskomplikation
8. Fische oder Supplemente?
9. PCOS– häufige Ursache für Infertilität
10. Fazit
Review–wobei hilft Omega-3?
In einem aktuellen Review von 2018 [11] werden die Ergebnisse 70 wichtiger RCT mit 19.927 Frauen zu Effekten von Omega-3 in der Schwangerschaft zusammengefasst. Dabei ergab sich ein um 11% verringertes Risiko von Frühgeburten vor der 37. Woche (26 Studien mit 10.304 Frauen). Das Risiko von frühen Frühgeburten vor der 34. Woche war mit 42% aber noch deutlicher reduziert (9 Studien mit 5204 Frauen), wenn die Frauen Omega-3 eingenommen hatten. Für die Kinder fand sich ein um 25% geringeres Risiko für perinatalen Tod (10 Studien mit 7416 Frauen). Das Risiko für ein niedriges Geburtsgewicht war mit immerhin 10% leicht verringert (15 Studien mit 8449 Frauen). Präeklampsie trat unter Omega-3 noch 16% weniger auf (20 Studien mit 8306 Frauen). Damit darf als Evidenz basiert gelten, dass wesentliche Schwangerschaftskomplikationen signifikant weniger auftreten, wenn die Schwangere Omega-3 einnimmt. Dass diese Effekte nicht nur signifikant, sondern auch relevant sind, soll an einem Beispiel mit absoluten Zahlen verdeutlicht werden: Bei 7416 beobachteten Schwangerschaften starben 62/3715 Kinder perinatal in den Verum-, aber 83/3701 in den Placebogruppen. Das bedeutet eine absolute Risikoreduktion von nur 0,28% – aber diese Zahl stellt 21 tote Babys weniger dar!
Können wir „Frühchen“ verhindern?
Frühgeburten tragen ein hohes Risiko für Mortalität oder bleibende Behinderung in sich. Im oben erwähnten Review werden 9 Studien zitiert, die ein erniedrigtes Risiko für Frühgeburten, besonders aber für die frühen Frühgeburten ergaben. Beispielhaft möchte ich daraus eine Studie mit besonders eindrucksvollen Ergebnissen herausgreifen. In dieser Studie erhielten 350 Frauen ab der 20. Gestationswoche 600mg DHA aus Algenöl oder Placebo. Dies ist immerhin die dreifache Menge dessen, was derzeit in den gynäkologischen Leitlinien empfohlen wird (Infobox 1). Es gab 4,8% Frühgeburten vor der 34. Woche in der Omegagruppe vs. 0,6% in der Placebogruppe, was eine relative Risikoreduktion von 87,5% bedeutet. Nebenbei wiesen Frühgeborene in der Omegagruppe nur 9 Hospitalisierungstage vs. 41 in der Placebogruppe auf. Die Gestationsdauer war unter Verum durchschnittlich 3 Tage länger und das Geburtsgewicht ca. 200g höher[4].Die anderen Studien des Reviews wiesen nicht so deutliche Effekte auf setzten dabei aber auch geringere Dosen ein. Wenn die Erfolge bei der Vermeidung von Frühgeburten so klar sind, so erhebt sich die Frage, warum die Empfehlung zur Omega-3-Zufuhr nicht flächendeckend umgesetzt wird. Zum Vergleich: Neuralrohrdefekte haben eine Inzidenz von unter 1%. Folsäure in der Frühschwangerschaft wird allgemein empfohlen und auch konsequent umgesetzt. Die viel häufigeren Frühgeburten könnten wir nach der Datenlage zu einem großen Teil vermeiden. Hier gibt es aber noch deutlichen Handlungsbedarf. Eine australische Studie [15] widmete sich daher der Frage, wie die Prävention mit Omega-3 bei Schwangeren verbessert werden könnte.
763 Schwangere erhielten einen etwa 10min Zeit in Anspruch nehmenden Fragebogen zum Wissen und Verhalten bezüglich Ernährung und Frühgeburt. Nur 62% hatten überhaupt von Frühgeburten gehört. Immerhin 57% der Frauen hatten ihre Ernährung während der Schwangerschaft geändert und 82% nahmen Supplemente ein. 91% hatten schon von Omega-3 gehört. Immerhin 30% nahmen irgendein Omega-3 in irgendeiner Dosis während der laufenden Schwangerschaft ein und 32% aßen wenigstens zwei Portionen Fisch pro Woche, wohingegen 19% angaben, keinerlei Fisch zu essen. 90% der Frauen gaben an, ihre Omega-3-Zufuhr zu erhöhen, wenn ihnen dies von „health professionals“ (damit sind wohl hauptsächlich ihre Gynäkologen und Hebammen gemeint) empfohlen würde. 79% würden Omega-3 einnehmen, wenn es ihnen kostenlos zur Verfügung gestellt würde. Die Autoren folgern in ihrer Zusammenfassung, dass Strategien zur besseren Implementierung der Omega-3-Gabe bei Schwangeren nötig sind.
Abb.1 Die wichtigsten Omega-3-Fettsäuren
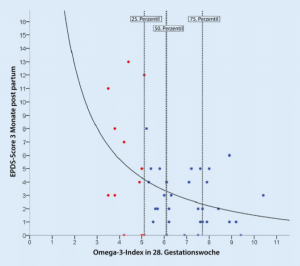
Abb.2 Statistischer Zusammenhang zwischen Omega-3-Index und Depressionsscore EPDS. (Aus Markhus et al.[10], ©2013 Markhus et al.)
Vermeidung atopischer Erkrankungen
Epidemiologen sind sich darüber einig, dass atopische Erkrankungen wie Neurodermitis, Asthma oder Allergien in den letzten drei Generationen rapide zugenommen und inzwischen epidemieartige Auswüchse angenommen haben. Ein systematisches Review [2] widmete sich Hinweisen auf eine Verminderung IgE-vermittelter Krankheiten bei Kindern unter Omega-3-Einnahme der Mütter in der Schwangerschaft. Hatten Mütter in der Schwangerschaft Omega-3 eingenommen, so kam es im Vergleich zu den Kindern der Mütter unter Placebo im Alter von 12 Monaten zu 31% weniger positiven Prick-Tests, 41% weniger Nahrungsmittelallergien und 47% weniger Neurodermitis. Diese Erkrankungen sind also allein unter Omega-3 in hohem Maße vermeidbar. Ein Cochrane-Review [6] bestätigte diese Daten bei etwas älteren Kindern im Alter von bis zu 36 Monaten. 8 Studien mit 3175 Kindern fanden bei Einnahme von Omega-3 der Mütter in der Schwangerschaft im Alter von 12 bis 36 Monaten 34% weniger IgE-vermittelte Allergien. Bei IgE-vermittelter Neurodermitis betrug die Risikominderung im ersten Lebensjahr 72%, im Alter von 1 bis 3 Jahren noch 39% und jenseits des dritten Lebensjahrs immerhin noch 16%. Das Risiko von Heuschnupfen war bei den 1–3 Jahre alten Kindern der Omega-3 Mütter um 47% erniedrigt, jenseits des dritten Lebensjahrs ließ sich keine Risikominderung mehr nachweisen. Als Nebenbefund konnte auch die Sicherheit von Omega-3 in der Schwangerschaft belegt werden. Aufgrund der thrombozytenaggregationshemmenden Wirkung von Omega-3 ist eine erhöhte perinatale Blutungsrate bei Müttern unter Omega-3 zumindest denkbar. Eine solche konnte in diesem Review widerlegt werden. Die Autoren des Cochrane-Review halten die Einnahme von Omega-3 in der Schwangerschaft für sicher. In einer Asthmapräventionsstudie [12] erhielten 736 Schwangere ab der 24. Gestationswoche randomisiert und doppelblind 2,4g Omega-3 (mehr als 1EL Fischöl!) oder Olivenöl. Im Alter von 3 Jahren wiesen die Kinder der Omega-3-Gruppe 16,9% Keuchen oder Asthma im Vergleich zu 23,7% bei den Kindern der Olivenölgruppe auf. Dies entspricht einer relativen Risikominderung von fast einem Drittel und einer NNT von etwa 14. In Subgruppen konnten sogar noch bessere Effekte nachgewiesen werden. Das Tertil der Frauen mit niedrigen Omega-3-Blutspiegeln wies bei den Kindern 17,5%vs. 34,1% Keuchen oder Asthma auf (alle Kinder der Untersuchung wiesen also im Alter von 3 Jahren ein Asthmarisiko von einemViertel, die Kinder der Mütter mit niedrigen Omega-3-Spiegeln aber von einem Drittel auf). Dies entspricht dann einer relativen Risikominderung von mehr als der Hälfte und einer NNT von etwa 6. Die Kinder der Frauen mit einer genetischen Prädisposition für Asthma (GG-Genotyp im FADS-Gen) hatten Inzidenzen von 15,2% vs. 37,8%, was einer relativen Risikominderung von etwa zwei Dritteln und einer NNT von 5 entspricht. Die Studie zeigt also klar auf, dass Asthma bei Kindern zu einem guten Maß vermindert werden kann, besonders aber dann, wenn die Risiken durch eine besonders schlechte Versorgung mit Omega-3 oder eine genetische Neigung erhöht sind. Um solche Effekte zu erreichen, müssen aber wesentlich höhere Dosen (mehr als 2g EPA/DHA) als die bisher offiziellen Dosen (200mg DHA) gegeben werden. Nach diesen Ergebnissen sollte jede Schwangere zur Vermeidung atopischer Erkrankungen beim Kind Omega-3 nehmen. Aber was ist mit Schwangeren mit familiärer Disposition? In dieser Studie
wurden 145 entsprechende Schwangere von der 25. Gestationswoche bis 3,5 Monate postpartal mit 2,7g EPA/DHA (etwa 1–1,5EL Fischöl) oder Placebo behandelt [5]. In der Placebogruppe wurden im Alter bis zu 2 Jahren 30% IgE-vermittelte Allergien beobachtet, was bei der familiären Belastung nicht überrascht. In der Omega-3-Gruppe traten jedoch nur 13% auf. Das sind absolut 17% und relativ 57% vermiedene Allergien, was einer NNT von 6 entspricht – nur 6 Schwangere mit familiärer Disposition müssten (eine relativ große Menge) Omega-3 nehmen, damit ein Kind von einer Allergie verschont bleibt. Das ist eine so niedrige NNT, wie wir sie bei kaum einer medikamentösen Maßnahme in der Medizin finden.
Perinataler Tod
Das wohl entsetzlichste Erlebnis für werdende Eltern ist ein perinataler Todesfall. Glücklicherweise ist die perinatale Mortalität in den letzten Jahrzehnten in entwickelten Ländern immer weiter zurückgegangen und liegt derzeit bei etwa 500 pro 100.000 Geburten. Aber jeder einzelne Todesfall ist einer zu viel. Könnte hier Omega-3 etwa auch helfen? Ein systematisches Review mit drei Studien zur in trauterinen Wachstumsverzögerung gab dies bezüglich zwar keine Überlegenheit in den Omegagruppen [13]. Als „Nebenwirkung“ zeigte sich aber eine Verminderung der perinatalen Mortalität um 40%. Bei knapp 800.000 Geburten in Deutschland gibt es schätzungsweise 4000 perinatale Todesfälle. Könnte man rein rechnerisch tatsächlich 40% davon durch Omega-3 verhindern, wie es das Review andeutet, würde dies mehr als 1500 verhinderte Todesfälle pro Jahr bedeuten. Für die Schweiz darf man extrapoliert von etwa 150 weniger toten Säuglingen ausgehen
Stimmungsaufhellung durch Omega-3?
Die Häufigkeit einer postpartalen Depression wird mit einer Inzidenz von mehr als 10% angegeben und stellt eine enorme psychische Belastung nicht nur für die betroffene Mutter, sondern auch für das gesamte soziale Umfeld dar. In einer Studie wurde der Omega-3-Index mit dem Risiko für das Entstehen einer postpartalen Depression korreliert [10]. Der Omega-3-Index wurde in der 28.Gestationswoche Gemessen.Esergab sich eine klare negative Korrelation zwischen Omega-3-Index und EPDS (Edinburgh Postnatal Depression Scale). Je Höher der Omega-3-Index der Schwangeren war, desto weniger Depression trat auf (.Abb.2). Lag der Omega-3-Index oberhalb des 50. Perzentils, das bei einem Index von etwa 6%lag (als optimal werden 8–11% angesehen), so gab es keinen EPDS-Score über 6 und damit keine Depression. Umgekehrt betrachtet war etwa die Hälfte aller Frauen, die unterhalb des 25. Perzentils lagen, was einem Omega-3-Index unter 5% entsprach, in einer klinisch relevanten Depression! Die epidemiologischen Daten sind hinweisend auf eine präventive Wirkung von Omega-3 bei Depression, beweisend sind aber nur interventionelle Untersuchungen. In einer solchen erhielten 80 Erstgebärende mit einer Depression während der Schwangerschaft 1g Omega-3 oder Placebo für 6 Wochen. Unter Omega-3 kam es zu einem hochsignifikanten Rückgang von Depression. In der Omega-3-Gruppe sank der Depressionsscore von 16,52 auf 9,17, in der Placebogruppe von 17,47 auf 14,70 [8]. In einer anderen Studie erhielten 36 Schwangere mit einer„major depression“ 3,4g Omega-3 (entsprechend fast 2EL Fischöl) oder Placebo. In 62% kam es unter Omega-3 zu einer Besserung der Depression vs. nur 27% in der Placebogruppe. Eine komplette Remission erreichten 38% der Verum-, aber nur 18% der Kontrollgruppe [17].
Hashimoto – die häufigste Autoimmunkrankheit
Etwa 10% der Schwangeren entwickeln perinatal erhöhte Schilddrüsenantikörper. Bei 236 nicht rauchenden, bisher schilddrüsengesunden Kaukasierinnen wurden kurz nach der Geburt die Hashimoto-typischen Schilddrüsenantikörper bestimmt [1]. Dabei entwickelten Schwertfischesserinnen signifikant höhere Antikörper als die Konsumentinnen von fettigen Fischen. Mögliche Erklärungen sind der höhere Gehalt an Schwermetallen und anderen Toxinen (Schwertfische befinden sich am Ende der Nahrungskette und akkumulieren daher besonders viele Schadstoffe) sowie der höhere Omega-3-Gehalt in den fettigen Fischen.
Diabetes – die „süße“ Schwangerschaftskomplikation
2010 entwickelten 3,7% aller deutschen Schwangeren einen Gestationsdiabetes– Tendenz steigend. 140 Schwangere mit Diabetes erhielten 1,2g Omega-3 oder Placebo. Nach 6 Wochen Therapie war das HOMA-IR als Maß für die Insulinresistenz ohne Omega-3 um 0,6 Punkte angestiegen, in der Omega-3-Gruppe hingegen um 0,7 abgesunken. Zum Vergleich: Man spricht von einer Insulinresistenz, wenn das HOMA-IR >2,0 liegt –diese Unterschiede sind also nicht nur signifikant, sondern auch relevant. Die Forscher folgern, dass Omega-3 in der Schwangerschaft vor Diabetes zu schützen vermag [7].

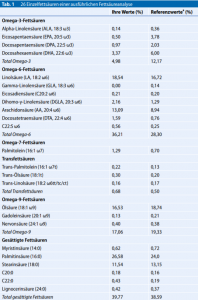
Abb.3 Wichtige Scores in einer Fettsäureanalyse
Fische oder Supplemente?
Um die in den meisten der zitierten Studien verwendeten Mengen von 2 bis 3g zu erzielen, benötigt man etwa 100g Makrele, 100g Hering, 150g Lachs, 300g Thunfisch oder 600g Kabeljau – allerdings täglich. Dies könnte toxische Belastungen zur Folge haben. Bei 145 gesunden Schwangeren wurde ein Ernährungsfragebogen erhoben und das Nabelschnurblut auf Quecksilber untersucht. In der Studie wurde ein Cut-off von >5,8μg/l Quecksilber gewählt. Zum Vergleich: Die Trinkwasserverordnung von Deutschland (https://www.gesetze-iminternet.de/trinkwv_2001/index.html) sieht einen Grenzwert von maximal 1μg/l für Quecksilber vor. Ungeborene von Schwangeren, die regelmäßig Fischessen, sind im Nabelschnurblut oft dem mehr als Fünffachen dieses Grenzwerts ausgesetzt –und dies monatelang. Nur 2,5% der Frauen, die Supplemente einnahmen, haben diesen Wert überschritten, aber 25,6% der Frauen mit hohem Fischkonsum (mit durchschnittlich >90g frischem Fisch oder >15g Dosenfisch pro Tag wurde der „hohe Fischkonsum“ definitionsgemäß bereits erreicht). Die Autoren folgerten: Hoher Fischkonsum ist ein Risikofaktor, der Konsum von Nahrungsergänzungen hingegen ein Schutzfaktor, was Belastungen mit Quecksilber für das Kind angeht [16].
PCOS– häufige Ursache für Infertilität
Das polyzystische Ovarialsyndrom ist eine häufige Ursache für Infertilität. Etwa 10% der Frauen sind davon betroffen. Die Hälfte der Frauen ist übergewichtig, viele haben eine gestörte Hormonbalance, Neigung zu Insulinresistenz bis hin zum Diabetes sowie erhöhte Entzündungswerte [9]. Als diätetische Empfehlungen werden 4 Gewichtsreduktion, 4 Restriktion raffinierter Kohlenhydrate, 4 Vermeidung von gesättigten und Transfettsäuren sowie 4 eine Erhöhung des Konsums von Omega-9-und Omega-3-Fettsäuren
angegeben [9]. In einem Review werden zahlreiche Studien aufgeführt, die belegen, dass Omega-3-Fettsäuren bei genau diesen Komplikationen des PCOS einen günstigen Einfluss haben [14].
Fazit
aDer Referenzwert ist ein Durchschnittswert einer definierten Gruppe mit „gesunden“ Fettsäurewerten. Die Datengrundlage baut auf 2000 Blutproben auf. Die Referenzwerte sollen bei der Analyse und Erklärung der individuellen Blutproben helfen. Die Referenzwerte sollen nicht als objektiv richtige Werte betrachtet werden
Bei allen meinen schwangeren Patientinnen untersuche ich neben anderen Nährstoffen (z.B. Eisen, Vitamin D, Selen, Zink) auch die Fettsäuren. Mein Labor untersucht dabei die Fettsäuren in der Erythrozytenmembran, was einen stabileren Wert darstellt als dieSerumanalyse, weil hier Ernährungseinflüsse der letzten Tage vor der Untersuchung stärker zu Buche schlagen. Es werden auch nicht die absoluten Fettsäurewerte in mg/l, sondern der prozentuale Anteil der Fettsäuren angegeben, weil es sonst bei sehr hohen Triglyzeriden falsch-hohe und bei sehr niedrigen Triglyzeriden falsch-niedrige Werte geben kann. Die beiden wichtigsten Score-Werte sind der Omega-3-Index (Summe von EPA und DHA im Verhältnis zu allen Fettsäuren) und das Omega-3-Verhältnis, wobei einige Labore alle Omega-6-Fettsäuren durch alle Omega-3-Fettsäuren teilen, andere hingegen nur den Quotienten AA/EPA berechnen – beide Werte haben aber eine hohe Korrelation miteinander (. Abb.3). Darüber hinaus werden 26 einzelne Fettsäuren bestimmt, die in der Summe nahezu 100% aller Fettsäuren ausmachen (. Tab. 1). Besonders wichtig sind dabei EPA (wichtigste antiinflammatorische Fettsäure), DHA (wichtig für die Kognition), AA (Arachidonsäure, wichtigste inflammatorische Fettsäure aus tierischen Fetten), LA (Linolsäure, Präkursor von AA, in vielen Pflanzenölen, z.B. Sonnenblumenöl) und GLA (Gamma-Linolensäure, z.B. aus Nachtkerzenöl, niedrige Werte sind mit Atopien assoziiert). In der vorliegenden Analyse fällt ein mit über 26 sehr hoher 6/3-Quotient auf, was für Entzündungskrankheiten prädestiniert. Ein„normaler“, aber nicht optimaler Wert bei einem Konsum von ca. 3- bis 4-mal Fleisch und 1-mal Fisch pro Woche liegt bei etwa 10. Als präventiv wirksam werden Quotienten von 3 bis 5 angegeben, wohingegen in der Therapie von chronischen Entzündungen ein Wert <2,5 angestrebt werden soll. Bei den einzelnen Fettsäuren fällt mit 0,5 ein sehr niedriger Wert für die EPA auf („normal“ ca. 1, optimal >3). Die AA aus tierischen Fetten ist dagegen mit über 13 sehr hoch, was erstaunlich ist, da es sich bei der Patientin um eine Veganerin handelt. Dies ist durch eine hohe Konversionsrate von LA zu AA zu erklären, die besonders dann erhöht ist, wenn die um die Umwandlung konkurrierenden Omega-3-Fettsäuren besonders wenig präsent sind, was gerade bei Veganern/Vegetariern häufig der Fall ist. Nach den vorliegenden Studien und Reviews ist es kaum nachzuvollziehen, warum – im Gegensatz zur völlig zu Recht etablierten Folsäure – so wenige Schwangere Omega-3 in der Schwangerschaft nehmen. Selbst die 200mg DHA, die in den offiziellen Leitlinien empfohlen werden, werden vermutlich viel zu selten genommen (eigene Erfahrung, genaue Zahlen hierzu liegen mir nicht vor). Schwangere berichten mir häufig, dass ihnen gesagt worden sei, dass eine Portion Fisch pro Woche völlig ausreiche. Für 200mg DHA müsste man aber eine Portion eines fetten Kaltwasserfischs (z.B. Hering oder Makrele) täglich verzehren. Wir haben gesehen, dass dies zu unverantwortlich hohen toxischen Belastungen im Nabelschnurblut führen kann. Um die Inzidenz atopischer Erkrankungen bei den Kindern zu minimieren, sind vermutlich sogar 2–3g EPA/DHA erforderlich. Ein gutes Fischöl ist praktisch schadstofffrei. Die Algen, aus denen das Öl gewonnen wird, kommen mit Meerwasser erst gar nicht in Kontakt. In einer Studie wurde die hohe Verantwortung hervorgehoben, die „health professionals“ haben, wenn es um die Ernährung/Nährstoffzufuhr bei den Schwangeren geht. Hier wäre ein Ansatz, die Schwangeren besser mit Omega-3 zu versorgen, um Komplikationen in der Schwangerschaft wie Frühgeburten, Gestationsdiabetes, Präeklampsie, Depression, perinatalen Tod sowie atopische Erkrankungen bei den Kindern vermeiden zu helfen. Wie viele Kosten könnten für die Solidargemeinschaft und wie viel Leid in den betroffenen Familien vermieden werden, wenn alle Schwangeren gut mit Omega-3 versorgt wären?
Einhaltung ethischer Richtlinien
Interessenkonflikt. V. Schmiedel hat in den letzten Jahren Vorträge zum Thema für die Firmen Biogena, Hepart, Loges, NatuGena und San Omega gehalten.
Für diesen Beitrag wurden vom Autor keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
1. Benvenga S, Vigo MT, Metro D, Granese R, Vita R, Le Donne M (2016) Type of fish consumed and thyroid autoimmunity in pregnancy and postpartum. Endocrine 52(1):120–129. https:// doi.org/10.1007/s12020-015-0698-3
2. BestK P, Gold M, Kennedy D, Martin J, Makrides M (2016) Omega-3 long-chain PUFA intake during pregnancy and allergic disease outcomes in the offspring: a systematic review and meta-analysis of observational studies and randomized controlled trials. AmJClinNutr103(1):128–143
3. Calder PC(2013) Omega-3 poly unsaturated fatty acids and inflammatory processes: nutrition or pharmacology? BrJClinPharmacol75 (3):645–662. https://doi.org/10.1111/j.1365-2125.2012.04374. x
4. Carlson SE, Colombo J, Gajewski BJ, Gustafson KM, Mundy D, Yeast J, Georgieff MK, Markley LA, Kerling EH, Shaddy DJ (2013) DHA supplementation and pregnancy outcomes. Am J Clin Nutr 97(4):808–815. https://doi.org/10.3945/ajcn.112. 050021
5. Furuhjelm C, Warstedt K, Fagerås M, Fälth Magnusson K, Larsson J, Fredriksson M, Duchén K (2011) Allergic disease in infants up to 2 years of age in relation to plasma omega-3 fatty acids and maternal fish oil supplementation in pregnancy and lactation. Pediatr Allergy Immunol 22(5): 505–514
6. Gunaratne AW, Makrides M, Collins CT (2015) Maternal prenatal and/or postnataln-3longchain polyunsaturated fatty acids (LCPUFA) supplementation for preventing allergies in early childhood. Cochrane Database Syst Rev 22(7): CD10085. https://doi.org/10.1002/14651858.CD010085. pub2
7. Jamilian M et al (2017) The effects of vitamin D and omega-3 fatty acid co-supplementation on glycemic control and lipid concentrations in patients with gestational diabetes. JClinLipidol. https://doi.org/10.1016/j.jacl.2017.01.011
8. Kaviani M, Saniee L, Azima S, Sharif F, Sayadi M (2014) The effect of omega-3 fatty acid supplementation on maternal depression during pregnancy: a double blind randomized controlled clinicaltrial.IntJCommunityBasedNursMidwifery 2(3):142–147
9. Liepa GU, Sengupta A, Karsies D (2008) Polycystic ovary syndrome (PCOS) and other androgen excess-related conditions: can changes in dietary intake make a difference? Nutr Clin Pract 23(1):63–71
10. Markhus MW, Skotheim S, Graff IE, Frøyland L, Braarud HC, Stormark KM, Malde MK (2013) Low omega-3 index in pregnancy is a possible biological riskfactor for postpartum depression. PLoS One 8(7):e67617.https://doi.org/10.1371/ journal.pone.0067617
11. Middleton P, Gomersall JC, Gould JF, Shepherd E, OlsenSF, Makrides M (2018) Omega-3 fatty acid addition during pregnancy. Cochrane Database Syst Rev 11:CD3402. https://doi.org/10.1002/ 14651858.CD003402.pub3
12. Rasmussen MA,Stark KD, Olsen SF, Bønnelykke K (2016) Fish oil-derived fatty acids in pregnancy and wheeze and asthma in offspring. N Engl J Med375(26):2530–2539. https://doi.org/10.1056/ NEJMoa1503734
13. Saccone G, Berghella V, Maruotti GM, Sarno L, Martinelli P (2015) Omega-3 supplementation during pregnancy to prevent recurrent intrauterine growth restriction: systematic review and meta analysis of randomized controlled trials. UltrasoundObstetGynecol46(6):659–664.https://doi. org/10.1002/uog.14910
14. Salek M, Clark CCT, Taghizadeh M, Jafarnejad S (2019) N-3 fatty acids as preventiv and therapeutic agents in attenuating PCOS complications. EXCLI J 18:558–575. https://doi.org/10.17179/ excli2019–1534
15. deSeymour JV, Simmonds LA, Gould J, Makrides M, Middleton P (2019) Omega-3 fatty acids to prevent preterm birth: Australian pregnant women’s preterm birth awareness and intentions to increase omega-3 fatty acid intake. Nutr J 18(1):74. https://doi.org/10.1186/s12937-0190499-2
16. Shih-Hui H et al (2017) High level of mercury in umbilical cord was 2.9 times more likely if eat fish instead of vitamin D supplements. J Chin Med Assoc. https://doi.org/10.1016/j.jcma.2016. 11.005
17. Su KP, Huang SY, Chiu TH, Huang KC, Huang CL, Chang HC, Pariante CM (2008) Omega-3 fatty acids for major depressive disorder during pregnancy: results form a randomized, double-blind, placebo controlled trial. JClinPsychiatry69(4):644–651
18. Young GS, Conquer JA, Thomas R (2005) Effect of randomized suppl
Quelle: Journal für Gynäkologische Endokrinologie/ Schweiz 1·2020







 Dr. med. Volker Schmiedel
Dr. med. Volker Schmiedel