Zusammenfassung
Omega-3 reguliert über den Prostaglandin- und Leukotrienstoffwechsel Entzündungen herunter, es moduliert ein überschießendes Immunsystem bei Autoimmunerkrankungen, schützt vor gefährlichen Herzrhythmusstörungen und wirkt über serotoninerge Effekte stimmungsaufhellend. Auch in der Krebsprävention und -therapie soll es eingesetzt werden. Gibt es dafür Evidenz in der wissenschaftlichen Forschung? Was sagt die Grundlagenforschung, welche Effekte konnten in epidemiologischen Studien aufgezeigt werden und existieren auch Interventionsstudien?
Omega-3: Gute Datenlage
Gibt man bei PubMed die Stichworte „cancer“ und „omega-3“ mit dem Filter „title“ und „clinical trial“ ein, so findet man 204 Studien und mit dem Filter „meta-analysis“ immerhin noch 27 Meta-Analysen (Stand 04.04.2015). Einige dieser Studien und Meta-Analysen sollen hier exemplarisch vorgestellt werden.
Beginnen wir mit einer aktuellen Meta-Analyse, die den Kenntnisstand zur Wirkung von Omega-3-Fettsäuren bei onkologischen Erkrankungen zusammenfasst [8]. In dieser Übersichtsarbeit werden die wichtigsten Wirkungen von Omega-3- Fettsäuren bei Krebs beschrieben. Es konnte inzwischen nachgewiesen werden, dass Entzündungen die Entstehung von Krebs, aber auch das Fortschreiten der Erkrankung fördern. Da Omega-3 natürlich entzündungshemmend wirkt, dient es der Vorbeugung von Krebs, was inzwischen in zahlreichen epidemiologischen Studien für unterschiedlichste Krebsarten belegt werden konnte. Ist Krebs aber erst einmal aufgetreten, so gilt es heute als gesichert, dass bei hoher Zufuhr von Omega-3 die Nebenwirkungen einer Chemotherapie geringer ausfallen (z.B. besserer Erhalt von Muskelmasse), die Chemotherapie wirkt darüber hinaus sogar besser auf den Krebs.
Fukui [6] versetzte in einer experimentellen Forschungsarbeit Prostatakrebszellen in der Zellkultur mit der Omega-3- Fettsäure EPA. Dies führte zu einer besseren Apoptose der Zellen. Mäuse, die mit EPA und DHA gefüttert wurden, zeigen geringeres Tumorwachstum nach einer Impfung mit Pankreaskrebszellen.
Epidemiologische Datenlage am besten
Die meisten Daten gibt es zu epidemiologischen Studien. Hier wurden gute Korrelationen zwischen hohen Omega-6/3-Quotienten in der Nahrung, im Fettgewebe oder als Blutspiegel und der Häufigkeit verschiedener Krebsarten wie Brust-, Endometrium- oder Prostatakrebs gefunden.
556 Frauen mit Endometriumkarzinom wurden mit gesunden Frauen gematcht. Dann teilte man die Frauen in vier gleiche Gruppen je nach der Höhe ihrer Omega-3-Zufuhr ein und errechnete das Risiko, an Endometriumkarzinom zu erkranken [2]. Die Frauen mit der besten EPA-Zufuhr hatten demnach nur ein RR von 0,57 im Vergleich zu denen mit der schlechtesten Zufuhr – das Risiko war also fast um die Hälfte vermindert. Bei DHA betrug das RR 0,64. Nahmen Frauen Omega- 3-Kapseln (egal welche Menge und welche Qualität) ein, betrug das RR nur 0,63, war also etwa um ein Drittel vermindert. Wenn Frauen Fischöl in einer guten Qualität und in einer ausreichend hohen Dosierung einnehmen, darf spekuliert werden, dass das Risiko möglicherweise noch geringer ist. Es fand sich außerdem eine positive Korrelation zwischen Omega- 6/3-Quotient und dem Auftreten von Endometriumkarzinom. Je höher also das Verhältnis zwischen Omega-6 (schlechte entzündungsfördernde Fettsäuren, z.B. in tierischen Fetten) und Omega-3 (Fischöl) ist, umso größer ist die Wahrscheinlichkeit für den Krebs [2].
1000 Patienteninnen mit Brustkrebs wurden bezüglich ihrer Ernährung untersucht und die Zufuhr an Omega-6- und Omega-3-Fettsäuren berechnet [3]. Dabei konnte nachgewiesen werden, dass Frauen mit einer hohen Zufuhr an Omega-6 ein RR von 1,92 für Brustkrebs aufwiesen, das Risiko war also fast verdoppelt. Merkwürdigerweise galt dies nur Frauen nach den Wechseljahren. Hohe Omega-3-Zufuhr verringerte dafür das Risiko für Brustkrebs auf 0,56, es wurde also fast halbiert. Dies galt aber nur für übergewichtige Frauen. Eine mögliche Erklärung wäre: Übergewicht führt zu mehr Entzündung. Entzündung fördert Krebs. Omega-3 wirkt antientzündlich und kann so die entzündliche Wirkung von Übergewicht zumindest teilweise kompensieren.
Kim [7] verglich 358 Patientinnen mit Brustkrebs mit 360 gesunden Frauen in Korea. Aus einem Ernährungsfragebogen mit 103 Fragen wurden Fisch-, EPA- und DHA-Konsum errechnet. Das Viertel der Frauen mit dem höchsten Fischkonsum hatte ein geringeres Risiko für Brustkrebs als das Viertel der Frauen mit dem niedrigsten Fischkonsum (Abb. 1). Das RR betrug 0,19 (vor den Wechseljahren) bzw. 0,27 (nach den Wechseljahren). Hoher Fischkonsum reduzierte also das Brustkrebsrisiko um 3/4 bzw. 4/5. Frauen, die mehr als 200 mg DHA zu sich nahmen, hatten im Vergleich zu denen mit weniger als 37 mg ein RR von nur 0,32, d.h. es war um etwa 2/3 reduziert.
In der EURAMIC-Studie [12], die in fünf europäischen Ländern durchgeführt wurde, verglich man den Fettsäuregehalt im Fettgewebe der Versuchspersonen mit dem Auftreten von Krankheiten. Dabei waren die Omega-6-Fettsäuren hochgradig mit Brustkrebs korreliert – je höher der Gehalt an Omega-6-Fettsäuren war, desto höher war das Brustkrebsrisiko. Bei den Omega-3-Fettsäuren war es hingegen genau umgekehrt. Das Drittel mit dem höchsten Omega-3-Gehalt im Fettgewebe hatte ein RR von 0,32 für Brustkrebs, also um etwa 2/3 geringer.
In der Meta-Analyse von Noel [11] wurden Studien zu Omega-3-Zufuhr und Hautkrebs zusammengefasst. Es wurde kein Zusammenhang zwischen Omega-3 und Basalzellkarzinom gefunden. Beim Plattenepithelkarzinom führte hoher Omega- 3-Konsum zu einem RR von 0,86, also einer leichten Risikominderung um etwa 1/7. Beide Krebsarten sind die so genannten „weißen Hautkrebse“. Beim Melanom, dem gefährlichen „schwarzen Hautkrebs“ führte hoher Konsum hingegen zu einem RR von nur 0,52, also fast einer Halbierung des Risikos.
Veierød [13] verglich in einer riesigen Untersuchung an mehr als 50.000 erwachsenen norwegischen Männern und Frauen das Auftreten von Lungenkrebs mit einer Omega-3-Supplementierung. Da Rauchen, Alter und Geschlecht bekannte Risikofaktoren für den Lungenkrebs darstellen, wurden die Daten nach diesen Risikofaktoren adjustiert, d.h. es wurde statistisch einberechnet, ob etwa unter den Omega- 3-Konsumenten mehr oder weniger Raucher, Ältere oder Jüngere, Männer oder Frauen waren. Nach dieser Adjustierung blieb ein RR von 0,5 für die Einnahme von Omega-3 zurück. Norweger, die Omega- 3 zusätzlich einnehmen, erkranken unabhängig von Rauchstatus, Alter und Geschlecht nur etwa halb so häufig an Lungenkrebs.
Negative Studien genau lesen
Immer wieder gibt es auch einmal „negative Studien“. Omega-3 weist hier keinen Nutzen oder sogar ungünstige Effekte auf. Solche Ergebnisse werden dann in der Fach- und Laienpresse oft sehr undifferenziert wiedergegeben. In dieser Meta-Analyse wurden 12 Studien zu Omega-3 und Prostatakrebs zusammengefasst. Das Ergebnis, welches als Sensationsmeldung verbreitet wird: Hohe Spiegel von EPA/ DHA erhöhten das RR für Prostatakrebs auf 1,38. Hoher Konsum an maritimem Omega-3 führt demnach zu einem Drittel mehr Prostatakrebs [5].
Folgende Fakten werden dann unterschlagen. Diese Daten gelten nur für einen ganz bestimmten Prostatakrebstyp. Für die anderen fand sich dieser statistische Zusammenhang nicht. Dieser Effekt wurde auch nur dann beobachtet, wenn eine der 12 Studien aus der Berechnung ausgeschlossen wurde. Die Studie wurde im Nachhinein ausgeschlossen, weil sie angeblich eine „schlechte Qualität“ habe. Statistisch ist dies aber nicht zulässig. Bei einer Meta-Analyse muss man vorher die Kriterien für einen Einschluss oder Ausschluss der Studie festlegen. Wenn man dabei keine statistisch eindeutigen Effekte findet und später eine oder mehrere Studien ausschließt, um doch noch Unterschiede errechnen zu können, so ist dies nicht zulässig.
Man muss also vielmehr dieser Meta- Analyse eine schlechte Qualität bescheinigen, wenn sie wissenschaftlich übliche Gepflogenheiten nicht berücksichtigt. Was in den Pressemitteilungen auch nicht erwähnt wird: Hohe DPA-Spiegel führten zu einer Minderung des RR auf 0,75 – dies galt dann aber nicht nur für einen bestimmten Prostatakrebstyp, sondern für alle – einschließlich des Typs, bei dem EPA/DHA eine Risikoerhöhung ergab. DPA ist aber eine Omega-3-Fettsäure, die auch in Fischöl vorkommt und die bisher in Untersuchungen wenig Beachtung gefunden hat.
Dies zeigt nebenbei, dass es wichtig ist, das Fischöl möglichst natürlich zu belassen, dann enthält es neben EPA und DHA auch den natürlichen Anteil von DPA. Es gibt inzwischen Fischölkonzentrate, die hohe Anteile von EPA und DHA enthalten, andere natürliche Anteile wie DPA werden aber vermindert – wir brauchen vermutlich alle natürlichen Inhaltsstoffe. Mit der Risikobetrachtung von Omega-3 bei Prostatakrebs ist es also etwas schwieriger als bei allen anderen Krebsarten. Aber selbst bei dieser Studie findet sich nur in einem kleinen Teilaspekt eine Risikoerhöhung. Das Gesamtrisiko ist bei hohem Fischkonsum (mit DPA) um ein Viertel erniedrigt, so wie dies auch alle anderen Studien nahelegen. Aber diese Nachricht ist natürlich nicht so sensationell wie die Meldung: „Omega-3 macht Prostatakrebs!“
Gute Studien haben mehr Gewicht
In einer weiteren prospektiven Studie wurden von 14.916 gesunden Männern Blutproben gesammelt [4]. Innerhalb von 13 Jahren kam es zu 476 Fällen von Prostatakrebs. Nur bei diesen wurden die Fettsäuren in der Blutprobe zu Beginn der Studie untersucht und mit denen von gesunden Kontrollpersonen verglichen. Das Fünftel mit dem höchsten EPA-Spiegel hatte nur ein RR von 0,57 für einen Prostatakrebs, bei DHA betrug das RR 0,60. Das Fünftel mit dem höchsten AA/EPAQuotient hatte hingegen ein RR von 1,30. Diese Zusammenhänge waren statistisch signifikant. Zwischen ALA (Omega-3 aus Lein- oder Rapsöl) und Prostatakrebs gab es hingegen keinen statistisch signifikanten Zusammenhang – nur die Fettsäuren aus Fischöl zeigten in dieser Studie eine Schutzwirkung [4].
Dass Omega-3 auch noch hilfreich sein kann, wenn Prostatakrebs bereits besteht, zeigt die folgende Studie. Moreel [10] maß den EPA-Gehalt im Prostatagewebe bei 48 Patienten mit einem niedrig-malignen Prostatakrebs. Nach einem halben Jahr erfolgte eine Kontrollbiopsie. Dabei fand sich bei den Männern mit einem guten EPA-Gehalt der Prostata eine deutlich geringere Progredienz.
In dieser Meta-Analyse [14] wurden die Daten von 6 Fall-Kontroll-Studien und von 5 Kohortenstudien berücksichtigt. Dabei wurden 8331 Fälle von Brustkrebs in einer Population von 274.135 Frauen verschiedener Länder erfasst. Der Omega-3/ 6-Quotient korrelierte dabei signifikant mit einem geringeren Risiko für Brustkrebs. Die Forscher errechneten dabei für einen 10 %igen Anstieg der 3/6-Ratio eine 6 %ige Reduktion des Krebsrisikos (Abb. 2). Bei US-Amerikanerinnen war dieser Unterschied sogar noch größer: Hier konnte eine 27 %ige Reduktion des Krebsrisikos gemessen werden. Hier wurde jedoch der 3/6-Quotient gebildet, nicht wie sonst üblich der 6/3-Quotient – ein hoher Quotient bedeutet hier also eine hohe Omega-3-Zufuhr. Anmerkung des Autors: Möglicherweise haben die Amerikanerinnen aufgrund einer besonders Omega-6-reichen Ernährung (viel Fleisch, Käse, Maisöl) einen besonders hohen Profit, wenn sie Omega-3-reiche Speisen verzehren.
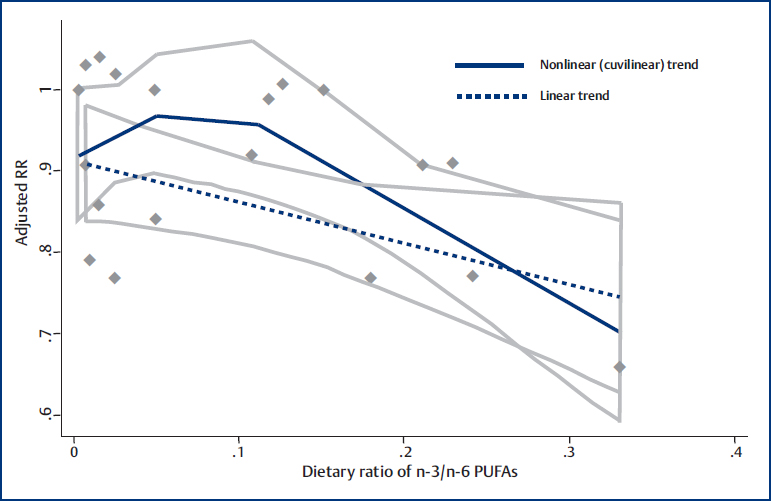
Abb. 2: Das RR sinkt mit steigendem Omega-3/6-Quotienten kontinuierlich ab. (Aus: Yang B, Ren XL, Fu YQ, Gao JL, Li D. Ratio of n-3/n-6 PUFAs and risk of breast cancer: a meta-analysis of 274135 adult females from 11 independent prospective studies. BMC Cancer 2014; 14: 105. Published online 2014 Feb 18. doi: Published online 2014 Feb 18. doi: 10.1186/1471–2407– 14–105)
Nutzen auch noch Jahre nach der Krebsdiagnose
39 Monate nach Diagnosestellung wurde bei 633 Patientinnen mit Brustkrebs die Fettsäurezufuhr mit dem Auftreten von Fatigue (Erschöpfung) verglichen. Fatigue ist das Symptom, welches Krebspatienten am meisten belastet – nicht etwa Schmerzen, Übelkeit oder Depression. Die Erschöpfung durch die Krankheit und/oder die Therapie nimmt Krebspatienten am meisten mit. In der Studie hat man die Patientinnen nach dem Omega-6/3-Quotienten verglichen. Das Drittel mit dem höchsten Quotienten – also der höchsten Omega- 6- bzw. der niedrigsten Omega-3-Zufuhr – hatte ein 2,6fach erhöhtes Risiko für das Auftreten eines bedeutsamen Fatigue- Syndroms. Oder umgekehrt: Omega-3 schützt auch nach Auftreten der Krebserkrankung vor dem schlimmsten Krebssymptom, der Erschöpfung [1].
Ausblick: Die größte Interventionsstudie
Derzeit läuft gerade das VITamin D and OmegA-3 TriaL (VITAL). Diese Interventionsstudie wird voraussichtlich 2018 beendet sein [9]. Obwohl also noch gar keine Ergebnisse vorliegen, soll diese größte und teuerste Omega-3-Studie aller Zeiten hier vorgestellt werden. 20.000 Männer ≥ 50 und Frauen ≥ 55 Jahren wurden in die Untersuchung eingeschlossen. Zu Beginn wurden bei 16.000 Versuchspersonen Blutproben genommen und auf die Fettsäuren und auf Vitamin D untersucht. Am Ende werden noch einmal 6.000 Laborkontrollen stattfinden. Die Teilnehmer werden randomisiert auf vier Versuchsarme aufgeteilt, die folgende Präparate erhalten: 1 g Omega-3, 2000 IE Vitamin D, beides oder nur Placebo.
Am Ende des Versuchs stehen so genannte „harte Endpunkte“. So werden zahlreiche Krankheiten dokumentiert, z.B. verschiedene Krebsarten, Knochenbrüche, Herzinfarkte, das Auftreten von Rheuma, Asthma, Diabetes und viele andere Krankheiten, bei denen ein Zusammenhang mit Omega-3 und/oder Vitamin D vermutet wird. Diese Studie ist so teuer, dass sie von keiner Pharmafirma, die Omega-3 oder Vitamin D herstellt, finanziert werden kann. Es handelt sich um so genannte Non-Profit-Forschung, bei der die Gemeinschaft die Finanzierung übernimmt. Seit der Clinton-Administration werden pro Jahr weit mehr als 100 Millionen $ in die Erforschung komplementärer Verfahren gesteckt. Diese Studie kostet allein 30 Millionen $. Allein die Tatsache, dass die Entscheider über die Finanzmittel dem Studienantrag zugestimmt haben, bedeutet, dass man sich positive Ergebnisse erwartet.
Um einen guten Schutz vor Krebs zu haben, ist eine gute Versorgung mit Omega- 3 Vorraussetzung. Eine gute Versorgung liegt bei einer Omega-3-Zufuhr von 2 g EPA/DHA vor. Dies kann mit 300 g Makrelenfilet, 12 konventionellen Fischölkapseln oder einem TL eines hochwertigen Fischöls gewährleistet werden. Von Patienten kommt immer wieder die Frage nach – und auch von offiziellen Ernährungsgesellschaften kommt immer wieder die Empfehlung für – pflanzlichen Omega-3-Fettsäuren (ALA) aus Lein- oder Rapsöl. Ich persönlich halte dies Öle für sehr wertvoll- auf jeden Fall sind sie den omega-6- reichen Pflanzenölen wie Sonnenblumen oder Distelöl vorzuziehen. Es muss allerdings angemerkt werden, dass die präventiven oder therapeutischen Effekte in den Omega-Krebs-Studien sich praktisch ausschließlich auf EPA/DHA beschränken. Zu ALA gibt es praktisch keine oder sogar negative Daten [4].
Im zweiten Teil zum Thema Omega-3 und Krebs in der Ausgabe 3/2015 wird es dann weitere praktische Tipps zur Diagnostik und Therapie mit Omega-3 geben.
Literatur
[1]
Alfano CM, Imayama I, Neuhouser ML, Kiecolt- Glaser JK, Smith AW, Meeske K, McTiernan A, Bernstein L, Baumgartner KB, Ulrich CM, Ballard-Barbash R. Fatigue, inflammation, and ω-3 and ω-6 fatty acid intake among breast cancer survivors. J Clin Oncol 2012; 30(12): 1280–7
[2]
Arem H, Neuhouser ML, Irwin ML, Cartmel B, Lu L, Risch H, Mayne ST, Yu H. Omega-3 and omega-6 fatty acid intakes and endometrial cancer risk in a population-based case-control study. Eur J Nutr 2013; 52(3): 1251–60
[3]
Chajès V, Torres-Mejía G, Biessy C, Ortega- Olvera C, Angeles-Llerenas A, Ferrari P, Lazcano- Ponce E, Romieu I. ω-3 and ω-6 Polyunsaturated fatty acid intakes and the risk of breast cancer in Mexican women: impact of obesity status. Cancer Epidemiol Biomarkers Prev 2012; 21(2): 319–26
[4]
Chavarro JE, Stampfer MJ, Li H, Campos H, Kurth T, Ma J. A prospective study of polyunsaturated fatty acid levels in blood and prostate cancer risk. Cancer Epidemiol Biomarkers Prev 2007; 16(7): 1364–70
[5]
Chua ME, Sio MC, Sorongon MC, Morales ML Jr. The relevance of serum levels of long chain omega-3 polyunsaturated fatty acids and prostate cancer risk: A meta-analysis. Can Urol Assoc J 2013; 7(5–6): E333–43
[6]
Fukui M, Kang KS, Okada K, Zhu BT. EPA, an omega-3 fatty acid, induces apoptosis in human pancreatic cancer cells: role of ROS accumulation, caspase-8 activation, and autophagy induction. J Cell Biochem 2013; 114(1): 192–203
[7]
Kim J, Lim SY, ShinA, Sung MK, Ro J, Kang HS, Lee KS, Kim SW, Lee ES. Fatty fish and fish omega-3 fatty acid intakes decrease the breast cancer risk: a case-control study. BMC Cancer 2009; 9: 216
[8]
LavianoA, Rianda S, Molfino A, Rossi Fanelli F. Omega-3 fatty acids in cancer. Curr Opin Clin Nutr Metab Care 2013; 16(2): 156–61
[9]
Manson JE, Bassuk SS, Lee IM, Cook NR, Albert MA, Gordon D, Zaharris E, Macfadyen JG, Danielson E, Lin J, Zhang SM, Buring JE. The VITamin D and OmegA-3 TriaL (VITAL): rationale and design of a large randomized controlled trial of vitamin D and marine omega-3 fatty acid supplements for the primary prevention of cancer and cardiovascular disease. Contemp Clin Trials 2012; 33(1): 159–71
[10]
Moreel X, Allaire J, Léger C, Caron A, Labonté Mネ, Lamarche B, Julien P, Desmeules P, Têtu B, Fradet V. Prostatic and dietary omega-3 fatty acids and prostate cancer progression during active surveillance. Cancer Prev Res (Phila) 2014; 7(7): 766–76
[11]
Noel SE, StonehamAC,Olsen CM, Rhodes LE, Green AC. Consumption of omega-3 fatty acids and the risk of skin cancers: a systematic review and meta-analysis. Int J Cancer 2014; 135(1): 149–56
[12]
Simonsen N, van’t Veer P, Strain JJ, Martin- Moreno JM, Huttunen JK, Navajas JF, Martin BC, Thamm M, Kardinaal AF, Kok FJ, Kohlmeier L. Adipose tissue omega-3 and omega- 6 fatty acid content and breast cancer in the EURAMIC study. European Community Multicenter Study on Antioxidants, Myocardial Infarction, and Breast Cancer. Am J Epidemiol 1998; 147(4): 342–52
[13]
Veierød MB, Laake P, Thelle DS. Dietary fat intake and risk of lung cancer: a prospective study of 51,452 Norwegian men and women. Eur J Cancer Prev 1997; 6(6): 540–9
[14]
Yang B, Ren XL, Fu YQ, Gao JL, Li D. Ratio of n-3/n-6 PUFAs and risk of breast cancer: a meta-analysis of 274135 adult females from 11 independent prospective studies. BMC Cancer 2014; 14: 105; doi: 10.1186/ 1471–2407–14–105